Las pérdidas de material por la corrosión suponen un problema permanente para las industrias, llegando a representar del 5 al 7% del Producto Interior Bruto de un país desarrollado. A pesar de resultar una cuestión de gran envergadura, los expertos reconocen que este porcentaje podría reducirse considerablemente si se aplican determinados conocimientos sobre corrosión, tecnologías o métodos de protección contra la corrosión.
Índice
Artículo Patrocinado por Trafag
1. Introducción
Las pérdidas de material por la corrosión suponen un problema permanente para las industrias, llegando a representar del 5 al 7% del Producto Interior Bruto de un país desarrollado. A pesar de resultar una cuestión de gran envergadura, los expertos reconocen que este porcentaje podría reducirse considerablemente si se aplican determinados conocimientos sobre corrosión, tecnologías o métodos de protección contra la corrosión.(Heidersbach,1972: Vol. 13; Raichev et al.,2009; Shifler, 2005: 2335-2352).

La degradación de las máquinas y piezas en servicio es una realidad en cualquier campo de la ingeniería.
Combatir la corrosión significa:
- Alargar el tiempo de vida de la máquina.
- Disminuir los costos de mantenimiento.
- Diseñar con menor costo para una vida útil definida o detectar fracturas súbitas.
Este es el motivo de nuestro artículo, estudiar el fenómeno de la corrosión, sus causas, consecuencias, velocidad del proceso y en concreto el mar como agente corrosivo, todo ello con la finalidad de encontrar fórmulas que eliminen o retrasen sus efectos.
Objetivos del estudio y desarrollo del conocimiento y tecnología contra los efectos de la corrosión:

- Reducir costos a las empresas afectadas por los problemas que derivan de una avería o reparación, como son detener la producción o mantener varado un buque.
- Buscar alternativas que puedan sino frenar, reducir en el tiempo el deterioro de estos materiales. Y con ello las pérdidas ocasionadas por la interrupción de la productividad, más si cabe en la industria naval.
Resulta por tanto de suma importancia que el mantenimiento de la maquinaria industrial sea gestionado de correctamente para evitar futuros daños y facilitar el reemplazamiento de las piezas tan pronto como sea necesario.
2. ¿Qué es la corrosión? ¿Qué es la oxidación?
La corrosión es el deterioro de los materiales producido por la interacción fisicoquímica entre un metal y el entorno que le rodea. Si el ataque viene provocado por una reacción química la velocidad a la que se producirá esta corrosión variará en función de la temperatura y de la concentración de los reactivos y de los productos. Sumando a este deterioro el inevitable efecto tensional se provocan fracturas que se extienden a todas las instalaciones y máquinas industriales, entre otros: aplicaciones con agua de mar, navales, sistemas de gestión de agua de lastre o unidades de desalinización.
Este deterioro involucra reacciones de oxidación, que resultan del ataque del oxígeno, o agente oxidante a un material, provocado comúnmente por aire o agua. Mediante la reacción de oxidación, los iones que forman los metales pasan a solución acuosa que recibe el nombre de reacción anódica, y las regiones locales superficiales de los metales, donde se lleva a cabo la oxidación, se denominan ánodos locales.
2.1 Diferencias entre Corrosión y Oxidación
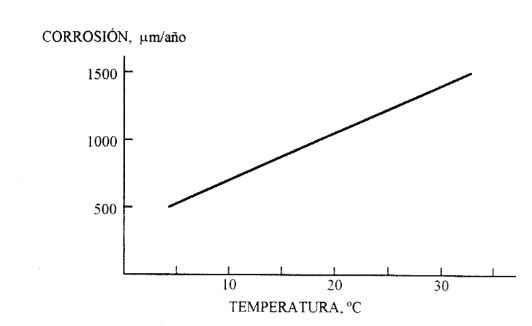
- El oxígeno produce sobre la superficie del metal un efecto oxidante en los metales, este efecto se ve incrementado por las altas temperaturas (ver gráfico del punto 2).
- Sin embargo, la corrosión es el resultado de un proceso lento y paulatino de deterioro por acción de un agente externo.
- La oxidación de un material, por medio del aire o del agua, provoca corrosión en el material. Mientras la oxidación es el ataque, la corrosión es el resultado, el deterioro.
- La corrosión, en definitiva, es un tipo de oxidación. Cuando la oxidación se ve incrementada a causa de las temperaturas y diluye el material podremos hablar de corrosión.
■ Ejemplo de corrosión:
Cuando nos encontramos con dos metales de diferente potencial, en contacto por medio de un fluido conductor denominado electrolito se manifiesta una corriente galvánica.
- Electrolitos típicos:
- Agua
- Aire Húmedo
Los metales por encima de la referencia (Fe) en la lista de potencial eléctrico, son denominados Metales Anódicos (se oxida) y los que se encuentran por debajo, metales catódicos (se reduce).
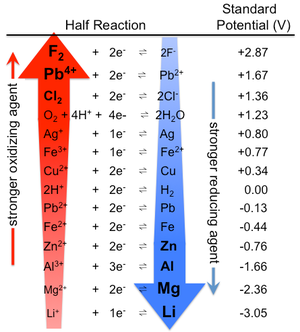
Por ejemplo, si tomamos como referencia un casco de un buque de hierro (Fe) y agua salada como electrolito (fluido conductor) podemos saber que los metales conectados eléctricamente al casco que tengan un menor potencial eléctrico que este elemento (Fe), se comportarán como ánodo, y por tanto se oxidarán.

Por este principio, los cascos de los buques de hierro se protegen con los denominados «ánodos de sacrificio«, generalmente compuestos de zinc y metales con menor potencial, de esta manera la reacción galvánica producida hará que el ánodo se oxide y el casco se reduzca, protegiendo así a la estructura de la oxidación.
Para conocer en profundidad conceptos sobre la corrosión, puedes visitar el siguiente artículo: Corrosión y Protección Catódica
3. Causas de la corrosión. El mar como agente corrosivo
Existen diferentes causas que provocan la corrosión de los metales: la humedad se erige como uno de los principales agentes corrosivos, al verse superado el 60% de humedad el deterioro comienza a ser significativo.
Pero la humedad no es la única causante del deterioro de los materiales, existen otras fuentes de oxidación que sería interesante conocer. Es el caso de:
- Las temperaturas elevadas: a más temperatura, más corrosión.
- La presencia del mar: en zonas cercanas a la costa la concentración de sal en el ambiente es superior, provocando un deterioro mayor.
- La contaminación industrial, ya que se trata de zonas que cuentan con un alto contenido en dióxido de azufre.
En este sentido, podemos discernir dos tipos de corrosión, las reacciones electroquímicas exigen necesariamente un electrolito conductor, que en la mayoría de los casos es el agua. Gran parte de los metales están sujetos a esta “corrosión acuosa”, generada por el agua y la atmosfera, y puede darse en ríos, mares, etc, siendo el oxígeno, el dióxido de azufre, las sales disueltas en el agua de los ríos, el agua salada de los mares o los organismos que viven en él los principales agentes corrosivos.
El segundo tipo de degradación se conoce como “corrosión seca”, que resulta de una reacción química con el medio en la que un material es atacado por temperaturas elevadas, ocasionado una degradación importante. Su manifestación puede darse a partir de muchos tipos de gases: oxígeno, CO, halógenos o el vapor.
3.1 El mar como agente corrosivo
La actividad corrosiva en agua de mar es tan alta, que en periodos muy cortos de tiempo se pueden provocar graves daños a las estructuras metálicas. El agua de mar resulta ser un electrolito muy complejo que se encuentra compuesto por sales disueltas que hacen de él un entorno muy agresivo para los metales, constituyendo desperfectos importantes en las estructuras metálicas en cortos periodos de tiempo, acortando su vida útil. (Schumacher, 1979; Aylor, 1995:307-315; Farro et al., 2009, 2: 114-122)

Esta degradación metálica variará en función de las condiciones a las que se encuentre expuesto el metal y de las que rodeen la zona específica del entorno marino. Todo ambiente marino está formado por las siguientes zonas de corrosión: la atmósfera marina (1), la zona de salpicado (2), zona de mareas, de océano poco profundo, de océano profundo y la zona de fangos. Teniendo cada zona un impacto diferente en el deterioro de los materiales.
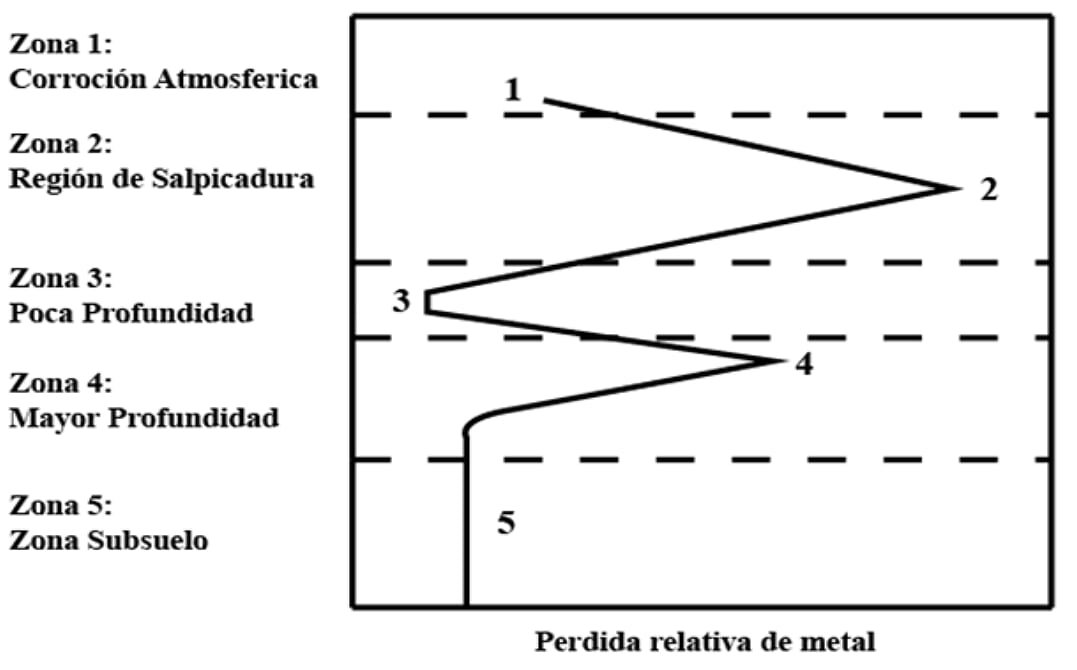
4. Prevención del proceso corrosivo
Si queremos evitar que se produzca algún tipo de corrosión, hemos de tomar nota de una serie de acciones que nos ayudarán a prevenir o disminuir el deterioro en los metales. Son las siguientes:
- Mantener las superficies metálicas secas, ya que tanto el agua como la humedad reproducen entornos favorables para la proliferación de la corrosión. Para ello, el metal debe estar siempre seco, para evitar la acumulación de agua y el inevitable deterioro.
- Las herramientas almacenadas por mucho tiempo deben ser protegidas de la humedad mediante el uso de elementos que ayuden a absorber la humedad.
- En el caso de que los materiales estén a la intemperie, resulta interesante revisar los materiales con los que éstos están fabricados y eligiendo aquellos como el aluminio o el acero inoxidable que resultan más resistentes ante la oxidación que el hierro.
- La utilización en los componentes eléctricos (cableado, interruptores, etc.) de productos de limpieza puede resultar un problema si no se secan bien o no se lleva a cabo un buen mantenimiento, generando como consecuencia corrosión.
- La utilización de pinturas a base de zinc sobre los materiales resulta un buen aislante contra la oxidación. El zinc actúa como ánodo de sacrificio, impidiendo que el metal que protege se vea dañado.
5. Elección de materiales. Sensores
La elección del material de las piezas y componentes es casi siempre un compromiso entre el rendimiento y el coste. A continuación, se presentan algunas consideraciones a la hora de elegir un transmisor de presión adecuado para aplicaciones con agua de mar, por ejemplo, en sistemas de gestión de agua de lastre o unidades de desalinización, donde existe un componente de corrosión elevado.

En general, estructuralmente hablando el metal más utilizado es el acero al carbono por su tenacidad y resistencia mecánica que ofrece para múltiples necesidades.
La mejor solución para cualquier aplicación con medios corrosivos es, desde el punto de vista del rendimiento, el uso del titanio, ya que ofrece una excelente resistencia a la corrosión. La gran desventaja del titanio es el altísimo costo del material en sí y el alto costo de su mecanizado.
Por lo tanto, los ingenieros buscan soluciones más rentables que sigan cumpliendo con los requisitos de la aplicación.
En muchos casos, se utiliza el AISI316L, que ofrece una resistencia a la corrosión razonable a un precio bastante bajo, ligeramente superior al del acero inoxidable básico, como el AISI1303. Pero la experiencia en campo muestra que los transmisores de presión con este material bastante común pueden fallar antes de tiempo debido a la corrosión. Generalmente, cuanto más alta es la temperatura y/o más alto es el contenido en sal, más rápido falla.
6. Prueba de niebla salina.
Para evaluar la resistencia a la corrosión de un acero, en particular en contacto con el agua de mar, hay dos parámetros clave:

- PREN: Pitting Resistance Equivalent Number (Número equivalente de resistencia a la corrosión)
- Medida de la resistencia a la corrosión en varios tipos de acero inoxidable.
- En general a mayor valor PREN, mayor resistencia a la corrosión por parte del acero
- PREN = 1 x %Cr + 3.3 x %Mo + 16 x %N (w/w)
- Se considera que un valor PREN32 para el acero indica resistencia a la corrosión del agua salada
- CPT Critical Pitting Temperature
- CPT =Temperatura más baja en la superficie de la muestra a la cual la propagación de la corrosión es estable bajo condiciones específicas (ISO 17864:2005)
- Diferentes métodos para definir el CPT. Fórmula empírica como regla general: CPT, (°C) = 10 + 7 x (%Mo)
■ Configuración de la prueba
- Prueba de niebla salina de acuerdo con IEC 60068-2-52:1996 (también parte de la especificación GL)
- Severidad nivel 1.
- Las muestras están expuestas a la niebla salina durante 2 horas
- Materiales de la toma de presión / carcasa para ECT 8472 / 8473
■ Resultados:

- AISI 303: Extensamente corroído
- AISI316L: Óxido fácilmente extraíble
- AISI318LN: Corrosión no visible
PREN (Pitting Resistance Equivalent Number) > 32 para aplicaciones de agua salada

7. Caso práctico. Trafag
Un cliente de Trafag que utilizaba transmisores de presión para unidades de desalinización especificó el material AISI316L. Funcionó bien en la mayoría de los casos, pero en las unidades utilizadas en las zonas tropicales, algunos de los transmisores se corroían después de un tiempo relativamente corto.
El cliente buscaba una mejor alternativa al AISI316L y el Titanio no era una opción por razones de costo.

La solución ofrecida por Trafag fue la instalación en las zonas críticas de sus trasmisores de presión cerámicos y una conexión de proceso de acero dúplex AISI318LN, ambos, elementos diseñados específicamente para este tipo de ambientes de alto índice de corrosión. Esta ha sido la solución perfecta para todas las instalaciones de este cliente tras comprobar el buen funcionamiento de los sensores incluso operando bajo temperaturas elevadas o con alto contenido en sal.
Un transmisor de presión de acero dúplex AISI318LN podría ser una solución perfecta para todos los casos, el costo del acero dúplex es ligeramente más alto que el AISI316L, pero sensiblemente inferior al del titanio. Por lo tanto, como siempre, los ingenieros necesitan evaluar cuidadosamente los riesgos de la aplicación y equilibrar entre un coste algo más elevado y un mejor rendimiento, en este caso ante la corrosión.
 Artículo Patrocinado por Trafag
Artículo Patrocinado por Trafag





buenas tardes, puede usarse sensores o valvulas de laton en zona costera, muy cerca del mar?